新型コロナワクチン総説
2022.5.3更新
![]()
①ワクチンの種類
ワクチン(予防接種)とは、ヒトの身体の中に病原体そのものや、病原体のからだの一部、病原体の出す毒素などを、ヒトに有害な影響を及ぼさないように処理した上で接種して、病原体に打ち勝つ抵抗力を獲得するものです。
ワクチンの投与方法には、注射(筋注、皮下注、皮内注射)、内服(経口)、点鼻があります。
まず始めに、ワクチンを分類します。
| 大分類 | 小分類 | ワクチン(青字はコロナワクチン) | |
| Ⅰ生ワクチン | ①生ワクチン | MRワクチン、水痘ワクチン、おたふくワクチン、BCG、ロタワクチン | |
| Ⅱ不活化ワクチン | ①不活化ワクチン(狭義) | インフルワクチン、ヒブワクチン、肺炎球菌ワクチン、日本脳炎ワクチン | |
| ②トキソイド | 破傷風トキソイド、ジフテリアトキソイド | ||
| ③組換え蛋白・ペプチドワクチン | B型肝炎ワクチン、ヌバクソビッド(ノババックス社製コロナワクチン)塩野義製コロナワクチン | ||
| ④VLPワクチン | HPVワクチン | ||
| Ⅲ核酸ワクチン | ①DNAワクチン | アンジェス国産コロナワクチン | |
| (遺伝子ワクチン) | ②mRNAワクチン | スパイクバックス(モデルナ社製コロナワクチン)、コミナティ(ファイザー社製コロナワクチン) | |
| ③ウイルスベクターワクチン | バキスゼブリア(アストラゼネカ製コロナワクチン) | ||
Ⅰ生ワクチン
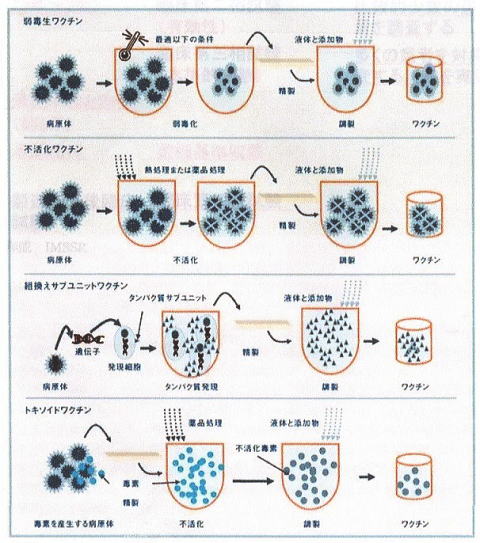 毒性をきわめて弱くした病原体を、生きたまま体に接種して、病気に軽く感染させ、しっかりした免疫をつけようというものです。
毒性をきわめて弱くした病原体を、生きたまま体に接種して、病気に軽く感染させ、しっかりした免疫をつけようというものです。
麻疹・風疹(MR)混合ワクチン、水痘ワクチン、おたふくワクチン、BCG、ロタウイルスワクチンがこれに含まれます。
Ⅱ不活化ワクチン
①(狭義の)不活化ワクチンは、細菌、ウイルスをこなごなにして、その一部の成分を体に注入するものです。
ヒブワクチン、肺炎球菌ワクチン、四種混合ワクチン(うち、百日咳、不活化ポリオ)、日本脳炎ワクチン、インフルエンザワクチン、髄膜炎菌ワクチンなどがこれに属します。KMバイオロジカル開発中のコロナワクチンもここに含まれます。
さらに、このグループの中には、組換え蛋白・ペプチドワクチン(不活化ワクチンに含まれるさまざまな成分の一部を、遺伝子組み換え技術を用いて、大腸菌や酵母菌の中に遺伝子を転写し、免疫獲得に必要な抗原蛋白やペプチドだけを大量に作らせたワクチン。アミノ酸が多いと蛋白、少ないとペプチドと呼びます。)があり、B型肝炎ワクチンがこれに属します。
ノババックス社製ヌバクソビッド、塩野義製薬開発中のコロナワクチンはこのグループに含まれます。
②トキソイドは、細菌が産生する毒素を無害化して、人に接種するものです。
ジフテリアトキソイド、破傷風トキソイドがこれに含まれます。
③VLP(Virus Like Particle=ウイルス様粒子)ワクチンは、ウイルスを包む殻のタンパク質の部分を人工的に合成して、人に接種するものです。これはにせものの中身の無いウイルスで、肝心の遺伝子が含まれていないため、病原体が増殖することはなく、病気も発病することはありません。
子宮頸がんを予防するHPVワクチンが、このVLPワクチンになります。(HPVワクチンについてはこちらをお読みください。)
(上図は、廣谷徹:ワクチンの種類より転載)
Ⅲ核酸ワクチン(遺伝子ワクチン)
核酸ワクチンは、コロナウイルスの遺伝子情報をヒトの体に注入するもので、さらに遺伝子の種類によって、DNAワクチンとRNAワクチンに分けられます。
DNA(デオキシリボ核酸)やRNA(リボ核酸)は核酸と呼ばれ、タンパク質の設計図(遺伝子と呼ばれます)です。塩基であるAアデニン、Gグアニン、Cシトシン、Tチミン、Uウラシルを対にして組み合わせて、対応するタンパク質を合成する情報コードです。(わかりやすい説明はこちらをご覧ください)
*細胞の中でDNAの持つ遺伝情報からタンパク質がどのように作られているのかは、こちらのアニメーションをご覧ください。
①DNAワクチンはヒトの体に接種されると、ワクチンに含まれるDNAはヒトの細胞核内に侵入し、mRNA(メッセンジャーRNA)を作ります。
このウイルスDNAの命令で作成されたmRNAは、細胞の核内から細胞質へ移動し、ヒトの細胞成分を勝手に使って、DNAの指示通りにウイルス蛋白を合成させます。
作り出されたウイルス蛋白は、ウイルスの成分であり、ヒトの体の一部では無いため、ヒトの免疫組織は異物(敵)として認識し、抗体を作って攻撃し、体の中から排除します。
この記憶は保存され、新たに同じ蛋白を持ったウイルスが侵入してきた時には、速やかに異物=敵として認識し、攻撃して排除します。これがDNAワクチンの原理です。
②mRNAワクチンは、DNAを介すことなく、直接ウイルス蛋白の設計情報を持ったmRNAをヒト体内に注入します。注入されたmRNAは、ヒトの細胞質でヒトの細胞成分を勝手に使って、設計図通りのウイルス蛋白を合成させます。
作り出されたウイルス蛋白は、ウイルス自身の成分であり、ヒトの体の一部では無いため、ヒトの免疫組織は異物(敵)として認識し、抗体を作って攻撃し、体の中から排除します。
しかし、注入されるmRNAは非常に脆弱で、ヒトのRNA分解酵素で簡単に分解されてしまうため、細かい脂肪の殻でmRNAを包み込み、脂質ナノ粒子(LNP:lipid Lipid-polymer nanoparticle)という安定したカプセルにして、壊れないよう注入します。
脂質ナノ粒子(LNP)でカプセル化したことにより、ヒトの細胞内にmRNAが取り込まれやすくなります。
![]() このワクチンで使用された、脂質ナノ粒子(LNP:Lipid-polymer nanoparticle)とは、直径が10nm(10ナノメータ)から100nm(100ナノメータ)の大きさの脂質(脂肪)を主成分とする粒子で、いろいろな成分が入っていて、細胞にくっつきやすい性質になっています。
このワクチンで使用された、脂質ナノ粒子(LNP:Lipid-polymer nanoparticle)とは、直径が10nm(10ナノメータ)から100nm(100ナノメータ)の大きさの脂質(脂肪)を主成分とする粒子で、いろいろな成分が入っていて、細胞にくっつきやすい性質になっています。
内部にDNA、RNAや薬物などを包み込んで運搬する、運搬係(ベクターと呼びます)として働きます。いわば、新型コロナウイルスの遺伝子情報を脂肪で包みこんで、ヒトの細胞に入りやすくする脂肪の殻のような存在、といえます。
この記憶は保存され、新たに同じウイルスが侵入してきたときには、速やかに異物として認識、攻撃し、排除します。これがmRNAワクチンの原理です。
さらにmRNAを取り込んだ細胞では、ウイルス遺伝子の命令で作られたウイルス蛋白の一部が細胞表面から顔を出して、まるでウイルス感染細胞のような、ヒトの細胞とは異なったおどろおどろしい顔つきになるため、免疫細胞=T細胞(リンパ球)に正体を見破られ、T細胞に攻撃されて破壊されます(細胞性免疫反応といいます)。
mRNAワクチンは液性抗体だけでなく、この細胞性免疫も獲得するため、効果がより強くなると考えられています。
現在接種が行われている、コロナワクチンのコミナティ(ファイザー社製)とスパイクバックス(モデルナ社製)は、このmRNAワクチンです。
核酸ワクチンは、生きた病原体を弱らせたり(生ワクチン)、粉々にしてその死骸の一部を体に注入するワクチン(不活化ワクチン)ではありません。
生きた病原体とは全く独立した核酸遺伝子断片を実験室内で化学的に作成し、さらに脂肪微粒子(LNP)で包み込んでヒトの体に注入するという、今までのワクチンとは全く新しい、異なる工程で作り出されるワクチンです。
このワクチン製造には、病原体の存在は必要なく、必要なのは核酸遺伝子(の一部)のため、短期間に大量生産が可能です。しかも病原ウイルスはいないため、病気の汚染の心配も全くありません。
また、RNAウイルスが変異しても、一部切り取ったRNA断片が変わっていなければ効果に問題はないし、変異した部分に該当するなら、別の核酸遺伝子の一部を増幅すれば良い、ということになります。
「工業生産」されたワクチンで、生物学というよりは化学の香りのするワクチンですね。
③一方、ウイルスベクターワクチンは、mRNAワクチンのように、病原ウイルスの蛋白を作るmRNAを、ヒト体内に直接注入するのではありません。
その代わりに、チンパンジーのアデノウイルスなど新型コロナウイルスと無関係な他のウイルスに、新型コロナウイルスの断片を作る遺伝子情報を組み込んで(無関係のウイルスの遺伝子を組換えて)、組み換え遺伝子を持つウイルスを人に注射します。
ヒトの体内に注入されたウイルスは、新型コロナウイルスのとげの蛋白(スパイク蛋白)を持っているため、このトゲの蛋白に対し、免疫が誘導されるようになります。
このウイルスは、新型コロナウイルスの遺伝子断片をヒトに運搬するだけの役割のため、ウイルスベクター(運び屋=ベクター・ウイルス vector)と呼ばれます。
バキスゼブリア(アストラゼネカ社製)は、このウイルスベクターワクチンで、実用化された史上2番目のワクチンとなります。(ちなみに史上1番目のウイルスベクターワクチンは、エボラウイルスに対して開発されたrVSV-ZEBOV vaccineです。)
厚労省新型コロナウイルス感染症対策推進本部が8月21日に委員会に提出した資料の図がわかりやすいので、転載いたします。
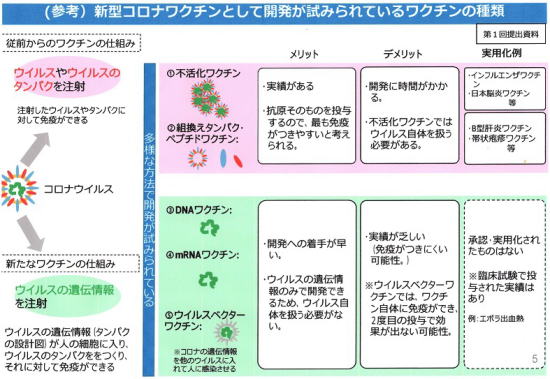 |
| ピンクエリアは従来型ワクチン。グリーンエリアは新しいワクチン。(厚労省新型コロナウイルス感染症対策推進本部) |
*新型コロナウイルスワクチンの4つの種類の解説アニメーションです。(There are four types of COVID-19 vaccines: here’s how they work )
![]()
②ワクチンの有効性
ワクチンの有効性は、次の3つの項目で評価されます。
①immunogenicity:免疫原性(血液検査の有効率)=ワクチンを接種されたヒトの血液中に出現した抗体のレベル(抗体価)が、感染や発病を阻止できるレベルに達したヒトの割合を調べます。
②efficacy:臨床試験の有効率=接種したヒトの群と、ワクチンを接種していないヒトの群(対照コントロール群)を比較して、発病したヒトの割合を調べます。
③effectiveness:実際の有効率=多くのヒトがワクチンが接種した後、実際にどのくらいヒトが発病し、感染症が実際に減少したかを調べます。
有効率はおもに発病するかどうかで評価することが多いですが、重症化率や致命率を指標にすることもあります。
核酸ワクチンの初期のデータでは、efficacyは90%以上(コミナティは95%、 スパイクバックスは94.1%)と報告されました。(これは初期のデータです。最新のデータは、各ワクチンの項をご覧下さい。)
![]() efficacy:臨床試験の 有効率90%とは、1000人ワクチンを接種したら、900人がコロナにかからなかった、という意味ではありません。1000人にワクチンを接種し、1000人に偽ワクチン(他のワクチンや生理的食塩水など)を接種した時に、ワクチン接種群で10人発病(0.01)し、偽ワクチン接種群で100人発病(0.1)したとすると、
このワクチンの有効率は1-0.1/1という計算で、90% と評価されるという意味になります。
efficacy:臨床試験の 有効率90%とは、1000人ワクチンを接種したら、900人がコロナにかからなかった、という意味ではありません。1000人にワクチンを接種し、1000人に偽ワクチン(他のワクチンや生理的食塩水など)を接種した時に、ワクチン接種群で10人発病(0.01)し、偽ワクチン接種群で100人発病(0.1)したとすると、
このワクチンの有効率は1-0.1/1という計算で、90% と評価されるという意味になります。
すなわち、偽ワクチンを接種した人と比較して、ワクチン接種したものの発病率(リスク)が相対的に90%減少した。あるいは、偽ワク
チンを接種した人のうち90%は、ワクチンを接種していれば発病しなかった。ということです。
![]()
③ワクチンの副反応
ワクチン接種は、健康な人に生きた病原体や死んだ病原体の一部を植えつけるものですから、必ず何らかの生体反応が起こります。このうち、生体に不利益な現象を有害事象adverase eventと呼びます。これは、ワクチン接種後のタイミングで起こる現象全てを含みます。極端な例として、ワクチン接種後、帰宅途中でころんで足を捻挫しても、ワクチン接種後の有害事象となるのです。
この有害事象のうち、ワクチン接種自体によって誘導された、健康不利益な現象を副反応adverse reactionと呼びます。ワクチン接種後に起こる注射部位の腫れやアナフィラキシーなどは代表的な副反応です。
1)一般的な副反応(注射部位が腫れる、痛み。全身違和感、頭痛、発疹など)
2)アナフィラキシー反応、ショックなどの重い副反応
3)mRNAワクチンの心筋炎・心膜炎、ウイルスベクターワクチンの血栓症など、それぞれのワクチンで報告された副反応は、各ワクチンの項で詳述しました。各項目をご参照下さい。
4)ワクチンの遺伝子が人に悪影響を与える、不妊になる、など、医学的に全く根拠のない悪質なデマ情報はこちらをご覧下さい。
①コミナティ筋注(ファイザー・ビオンテック社製のmRNAワクチン)
1)開発元
ドイツの遺伝子医薬品開発ベンチャー企業だったビオンテック社とアメリカの製薬企業ファイザーが、共同で開発したmRNA(メッセンジャーRNA)ワクチンです。
アメリカでは、2020年12月11日に緊急使用が認可され、イギリスではそれに先立ち2020年12月2日に通常認可がされました。
我が国でも、2021年2月15日、特例承認されました。
2)作用機序
新型コロナウイルスが細胞に侵入するときに、細胞に密着するスパイクと呼ばれる糖蛋白(ウイルスから出ているトゲの蛋白質)を設計する情報を持ったmRNA(メッセンジャーRNA)を、脂肪の膜である脂質ナノ粒子で包み込んで、ヒトに接種するmRNAワクチンです。
ヒト体内に注入されたmRNAが、ヒト体内の細胞質でヒトの成分を使って、SARS-CoV-2のスパイク蛋白を作ります。ところがこのウイルススパイク蛋白はヒトにとって異物のため、免疫が誘導されます。
ただし、この作成されたウイルスのスパイク蛋白自体は無害です。また、このスパイク蛋白が作られた後、ワクチンのmRNAはヒトの細胞で処理されて、数時間で破壊されます。mRNAがヒト体内に長く留まることはありません。
また、このmRNAはヒト細胞の細胞質リボゾームでスパイク蛋白を作り出しますが、ヒト細胞核内に侵入することは出来ないので、ヒトの遺伝子情報そのものが影響されることはありません。
3)接種の方法
成人用コロナワクチンは、21日の間隔(3週間)をあけて、上腕三角筋に0.3mlを2回筋肉注射します。
1回接種で52.4%ですが、2回接種で95%までefficacyが上昇するため、2回接種が必要とされています。(初期のデータです。)
しかし、アメリカの研究では、12歳以上における感染予防効果は、2回目接種後1ヶ月以内では88%、5~6ヶ月後には47%にまで低下していました。
また、発症予防効果についても、2回目接種後7日~2ヶ月未満では96.2%でしたが、4ヶ月以降では83.7%と低下していました。
そのため、現在3回目の追加接種が行われるようになりました。 (→コロナワクチン3回目接種についてはこちらをお読みください。)
他のワクチンとの同時接種はできません。コミナティ筋注を接種した前後14日間は、他のワクチンの接種は控えます。
2回接種後の、3回目の追加接種は同じmRNAワクチンのスパイクバックス(モデル社製ワクチン)の接種も認められています。
一方、小児用コロナワクチンは、21日の間隔(3週間)をあけて、2回上腕三角筋に0.2mlを注射します。
小児用コロナワクチンは今の所、3週間隔で2回接種で終了となっていますが、オミクロン株に対し、3回接種で発病予防効果が上昇することがわかっているため、いずれ3回目の接種が行われることになると思われます。
スパイクバックス(モデルナ社製ワクチン)は、3回目追加接種は同一のワクチン製剤を、0.5mlの半分の0.25mlを接種します。コミュニティは成人用では1,2,3回目は全て同じ量を接種します。
コミナティは成人用と小児用は製剤そのものが、全く別の製剤になっています。また、2022年6月現在、小児用コミナティは3回目接種は認められておりません。
 |
 |
| 成人用コロナワクチン(コミュナティ筋注) | 小児用コロナワクチン(コミナティ筋注5-11歳用) |
4)ワクチンの効果
このファイザーワクチンの第3相試験は、2020年7月からアメリカ、ブラジル、アルゼンチン、南アフリカ、ドイツなどの154施設で開始され、43538例が登録され、38955例が2回ワクチンの接種が行われました。解析結果は、ワクチンの発症予防効果は95%と報告されました。
一方、デルタ株については、発症予防効果は88%と報告されています。
無症状の感染を含めた感染予防効果は、12歳以上で2回目接種後1ヶ月以内では88%でしたが、5~6ヶ月には47%にまで有意に低下したとの報告があります。
また、発症予防効果についても、2回目接種後7日~2ヶ月未満では96.2%でしたが、4ヶ月以降では83.7%と低下していくことが確認されています。
![]() 小児用コミナティの効果については、こちらをご覧下さい。
小児用コミナティの効果については、こちらをご覧下さい。
5)ワクチンの対象
小児用コロナワクチンは5歳~11歳、成人用コロナワクチンは12歳以上が対象となります。
![]() ワクチン接種時の年齢が11歳の場合は、小児用で始め、2回目も小児用で接種を完了します。予診票・説明書のセットが小児用で届いても、接種開始時に12歳を過ぎていれば、成人用ワクチンを接種します。(予診票は同一なので、差し替えの必要はありません)
ワクチン接種時の年齢が11歳の場合は、小児用で始め、2回目も小児用で接種を完了します。予診票・説明書のセットが小児用で届いても、接種開始時に12歳を過ぎていれば、成人用ワクチンを接種します。(予診票は同一なので、差し替えの必要はありません)
6)ワクチンの副反応
局所症状として、接種部位の痛み、腫れ、赤くなる、接種した側の脇の下のリンパ節の腫れがみられます。
全身症状として、発熱、全身のだるさ、頭痛、寒気、筋肉痛、関節痛がみられます。
即時型反応(接種4時間以内に起こる、じんましん、むくみ、ぜいぜい、アナフィラキシーなど)の発生率は0.63%、プラセボ(ワクチンに似せた生食水など)では0.51%と報告されています。
これらの副反応は接種後3日以内に起こり、多くは1~2日の経過で消失すると報告されています。また、1回目より2回目の方が、また55歳以上より18歳~55歳の方が多く起るようです。
ただし接種によって副反応が起きたとしても、新型コロナウイルスワクチン接種でアナフィラキシーショックのような重い症状が出た人、ポリエチレングリコール(PEG)やポリソルビートに重大なアレルギー歴のある人*で無ければ、2回目の接種は可能です。
*このような体質の人は、ワクチンに封入されている脂質ナノ粒子(LNP)にアレルギー反応を起す可能性があるためです。
mRNAワクチンは、他のワクチンと比較しても、接種後の副反応が強く表われます。注射の痛みは、最も痛いと評価されてきたプレベナー13やニュ-モバックスと同等か、それ以上と報告されています。
![]() mRNAワクチンの副反応については、こちらもお読みください。
mRNAワクチンの副反応については、こちらもお読みください。
コミナティの我が国の副反応→伊藤澄信ら;健康観察日誌集計の中間報告(5):第20回厚生科学審議会予防接種・ワクチン分科会
③バキスゼブリア(アストラゼネカ社製のウイルスベクターワクチン) バキュロウイルス(蝶の幼虫に感染する、DNAウイルスでヒトに病原性はありません。)にコロナウイルス・スパイク蛋白の遺伝子情報を組み込み、昆虫細胞に感染させて、昆虫細胞にコロナウイルスのスパイク蛋白(抗原)を作らせます。この抗原を、脂質(ポリソルベート80)を核に集合させて粒子にして、ヒトに接種します。
②スパイクバックス(モデルナ社製のmRNAワクチン)
1)開発元
アメリカの遺伝子医薬開発ベンチャー企業のモデルナ社とアメリカ国立アレルギー・免疫研究所が共同で開発した、mRNAワクチンです。
アメリカでは2020年12月18日に緊急使用が許可され、イギリスでは2021年1月8日に通常認可されています。
我が国では2021年5月21日に初回接種(2回)が特例承認されました。追加接種については、2021年12月16日に薬事承認されました。
*認可当初は、「COVID-19ワクチンモデルナ筋注」という名称でしたが、2021年12月16日、「スパイクバックス筋注」と変更されました。
2)作用機序
コミナティと、同じmRNAワクチンのため、作用機序も同じです。(作用機序については、こちらをご覧下さい。)
3)接種の方法
初回接種(1回目、2回目)は、28日(4週間)の間隔を開けて、1回0.5mlを2回、上腕三角筋に筋注します。(対象は12歳以上。)
追加接種(3回目)は、初回接種後6週間以上あけて、1回0.25ml(初回接種量の半量)を上腕三角筋に筋注します。(ただし、対象年齢は18歳以上となっています)
初めの2回は、原則同じワクチンを接種します。3回目の追加接種は他のワクチンの接種(たとえば、コミナティ)も認められています。(例えば、モデルナ-モデルナ-ファイザー。)
他のワクチンとの同時接種はできません。また、モデルナのワクチン(スパイクバックス)を接種した前後14日間は、他のワクチンの接種は控えます。
![]() 非常に間違えやすい、複雑な設定になっています。スパイクバックスでは初回2回と追加3回目は、接種量も接種年齢も異なります。接種ミスを減らすよう、なるべく単純化(年齢、接種量)しようという配慮は、お役人には全くありません。ただただ、厚労省も保健所も注意するよう、通達を出すだけです。間違いでもしたら、「医療機関で誤接種!」とマスコミに通報され、さらし者にされます。
非常に間違えやすい、複雑な設定になっています。スパイクバックスでは初回2回と追加3回目は、接種量も接種年齢も異なります。接種ミスを減らすよう、なるべく単純化(年齢、接種量)しようという配慮は、お役人には全くありません。ただただ、厚労省も保健所も注意するよう、通達を出すだけです。間違いでもしたら、「医療機関で誤接種!」とマスコミに通報され、さらし者にされます。
ワクチンの有効期限も変更になりました。ワクチンバイアル、シールに貼ってある有効期限を越えて、接種が行われています。(報道の一例)
接種間隔も朝令暮改でころころ変えられています。3回目の接種間隔も、8ヶ月→6ヶ月→5ヶ月と変更されました。そのたびに、「期間を間違えると誤接種になるぞ。」と脅しの文句が医療機関に回ってきます。
医療機関の側も、コロナ対応だけでも大変なのに、このような(本来あまり問題とならないような)複雑極まりないルールを遵守し、接種するときにミスにならないよう細心の注意を払うなど、その精神的重圧は凄まじいものがあります。
4)ワクチンの効果
モデルナのmRNAワクチンの有効成分エラソメランの方が、ファイザーのmRNAワクチンの有効成分トジナメランよりも量が多いため、効果も強いが、副反応も強いようです。
▷18歳以上
<海外における臨床試験>
アメリカにおいて、約3万人の被験者を対象に、2回目の接種後14日以降の発症の有無が比較されました。その結果、過去に新型コロナウイルスの感染歴がない被験者において、94.1%のワクチン有効率が確認されました。(オミクロン流行前の研究です)
<国内における臨床試験>
日本人の健康成人200人をワクチンとプラセボ(生食水などのにせのワクチン)に分け、約28日間の間隔で2回接種しました。そして、2回目の接種から28日後の、接種した人のコロナウイルスに対する血液中の抗体を調べた所、抗体価の上昇が確認されました。
▷12~17歳
<海外における臨床試験>
12~17歳の約3000人の健康人を対象に、ワクチンとプラセボ(生食水などのにせのワクチン)に分け、約28日間の間隔で2回接種した時の、新型コロナウイルス感染症の発症がどの程度抑えられるか、比較しました。
2回目の接種後14日以降の発症について、過去に新型コロナウイルスの感染歴がない被験者では、100.0%のワクチン有効率が確認されました。
▷追加接種(3回目接種)の効果
<海外における臨床試験>
アメリカにおいて、18歳以上の人に、2回目の接種から6か月以上あけて、3回目のワクチン接種を行いました。接種した1か月後に、血液中の新型コロナウイルスに対する抗体を調べました。
1、2回目にエラソメラン100μgを接種した人に、3回目50μgを接種したところ、3回目接種の人で高い抗体価が得られました。
4)ワクチンの副反応
副反応については、こちらもお読みください(ワクチンの副反応参照)。
5)ワクチンの対象
1,2回の初回接種は12歳以上、3回目は18歳以上が対象です。
6)問題点
コミナティのように、-75℃という超低温で管理する必要がなく、流通・管理はコミナティに比べてはるかに楽です。モデルナワクチンは普通の冷蔵庫(2~8℃)で30日、品質は安定しており、-20℃なら6ヶ月間保存できるようです。
また、コミナティのように希釈精製することなくバイアルから吸い取るだけなので、操作が簡単なため、集団接種に適しています。
集団での接種に向いているので、集団接種、職域接種に使用されましたが、副反応が強いこと、特にモデルナアームや心筋炎などが警戒されたためか、接種希望者は少ないようです。
![]() 各地方自治体では、続々廃棄処分のなるようです。あの大騒ぎは何だったのでしょうか。(報道の一例)
各地方自治体では、続々廃棄処分のなるようです。あの大騒ぎは何だったのでしょうか。(報道の一例)
1)開発元オックスフォード大学とイギリスの製薬企業アストラゼネカ社が共同で開発した、ウイルスベクターワクチン(遺伝子組換え)です。イギリスでは2020年12月30日に通常認可されました。
我が国では、2021年5月21日に特例承認され、8月3日臨時接種の使用ワクチンに追加されました。
2)作用
バキスゼブリア(アストラゼネカのワクチン)はウイルスベクターワクチンと呼ばれます。正式名称は、遺伝子組換えサルアデノウイルスベクターワクチンといいます。
このワクチンは、①ワクチンの種類Ⅰ核酸ワクチン②で解説した通り、mRNAワクチンのように、病原ウイルスの蛋白を作るmRNAを、そのままヒト体内に直接注入するものではありません。
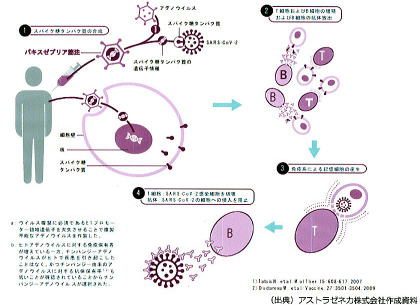 右図に示したように、チンパンジーのアデノウイルスなど、新型コロナウイルスと無関係な他のウイルスを、増殖できないように処理した上で、新型コロナウイルスのトゲ(スパイク)の断片を作る遺伝子情報を組み込みます(無関係のウイルスの遺伝子に組換えを行います)。
右図に示したように、チンパンジーのアデノウイルスなど、新型コロナウイルスと無関係な他のウイルスを、増殖できないように処理した上で、新型コロナウイルスのトゲ(スパイク)の断片を作る遺伝子情報を組み込みます(無関係のウイルスの遺伝子に組換えを行います)。
そして、組み換え遺伝子を持つウイルスごと、人に接種します。
ヒト体内に注入されたウイルスは、新型コロナウイルスのとげの蛋白(スパイク蛋白)を持っているため、ヒト細胞内に侵入した後、ヒトの細胞成分を勝手に使って、新型コロナウイルスのスパイク蛋白を作り始めます。
このトゲの蛋白(スパイク蛋白)は細胞表面に顔を出し、免疫担当細胞によって異物(敵)として認識され、免疫反応が誘導されることになるのです。
サルアデノウイルスは、新型コロナウイルスの遺伝子をヒトに運搬するだけの役割のため、ウイルスベクター(運び屋=ベクター・ウイルス vector)と呼ばれます。
*上図は、2021年5月21日厚生科学審議会予防接種・ワクチン分科会提出資料から転載
*アストラゼネカ:アデノウイルスベクターワクチンの製造(動画)
3)接種方法
8週から12週の間隔で2回、上腕三角筋に1回0.5mlのワクチンを筋肉注射します。
*標準的には、27日(1ヶ月)から83日(3ヶ月)の間に行うとされています。すなわち、4週以上あければ接種は可能ですが、2回目は2ヶ月後がよいと思います。
最初の2回は変更すること無く、バキスゼブリアを接種することが必要です。(mRNAワクチンとは作用が違うため)
接種年齢は18歳以上となっていますが、血栓症などのリスクを考えると、40歳以上が推奨年齢と思われます。
4)ワクチンの効果
アストラゼネカ社は2020年11月23日に臨床第3相試験で2回接種群で62%、1.5回接種群で90%の有効性があったと発表しました。(しかしこの結果の解釈には、大きな問題があったのです=後述。)
アストラゼネカ社は、イギリス、アメリカ、ドイツ、フランス、イタリア、オランダの欧州包括ワクチン同盟(IVA)、インド、Gaviアライアンスなどさまざまな国や団体と協定を結び、年間20億本以上の供給をめざしていました。
しかし、本来2回標準量で接種し、行われるべき治験が、誤って半量を用いた試験が行われたことが明らかになり、試験の信頼性が大きく揺らぎました。そのため、泥縄式に追加の臨床試験が計画されました。
結局、アストラゼネカのワクチンの効果について、4回の異なる臨床試験が行われました。「COV001」「COV002」「COV003」「COV005」と名付けられた4回の治験のうち、「COV001」「COV005」の2回は安全性評価と用量決定のために行われたもので、実質上のは「COV002」「COV003」の2つの治験成績でワクチンの効果が検証されたのです。
①参加者:
18歳以上。(中央値記載なし)除外は記載なし。
②投与法:
LD/HD;1回目 低用量(投与量は2.2×1010含有)→2回目 標準量(5.0×1010)で行った試験。
HD/HD;1回目 標準量(5.0×1010)→2回目 標準量(5.0×1010)で行われた試験。
偽ワクチンには、髄膜炎菌ワクチンACWYが使用されましたが、一部は生理食塩水も使用されたようです。
接種方法は、2回接種で、肩三角筋に筋肉注射。間隔は4~12週以上となりました(これは、治験進行中に混乱して、間隔が延びた例が出てしまったためです)。
③発症の予防効果:2回目接種14日後以降の新型コロナウイルス感染症発症数で比較されました。
LD/HDワクチン接種群 3人/1367人年、偽ワクチン接種群 30人/1374人年。Efficacy(臨床試験の有効率)は90.0%。
HD/HDワクチン接種群 27人/4440人年、偽ワクチン接種群 71人/4455人年、Efficacy(臨床試験の有効率)は62.1%。
その後の報告なども加味すると、発病予防効果は約70%。ただし、オミクロン株に対しては大幅に有効性は低下するようです。
④有害事象
次の章(5)ワクチンの副反応)で詳述します。
5)ワクチンの副反応
局所症状としては、
注射部位の腫脹発赤、内出血、痛みやかゆみ、接種した側の脇の下のリンパ節の腫れなど、
全身の症状としては、
疲労、頭痛、倦怠感(だるさ)、筋肉痛、発熱感、悪寒、関節痛、吐き気などがみられます。
これらは、接種したときから出現し、1~3日以内に治まる事が多いです。
また、1回目の方が2回目より副反応が出やすいようです。
厚労省:アストラゼネカ社の新型コロナワクチンについての国内256例の副反応報告を転載しました。
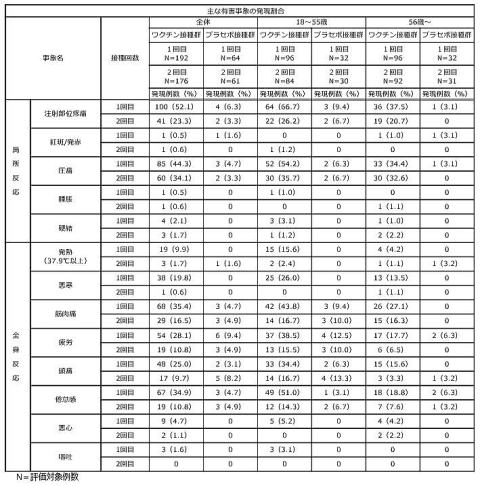
即時型反応(接種4時間以内に起こる、じんましん、血管のむくみ、ぜいぜい、アナフィラキシーなど)の発生は0.63%(プラセボ偽薬では0.51%)と報告されています。
また、過度の緊張などによる血管迷走神経反射による失神も時に見られます。(これはどのワクチンでも起こりえます)
バキスゼブリアで特に問題となる副反応は、①血栓症と②毛細血管漏出症候群、③ギランバレー症候群です。
①血小板減少症を伴う血栓症(TTS:Thrombosis with Thrombocytopenia Syndrome)
バキスゼブリア接種後の、きわめてまれですが、もっとも重大で警戒すべき合併症です。
2021年4月に、血小板減少を伴う血栓症(TTS)を欧州医薬品庁(EMA)は「非常にまれな副反応」と認定しました。
TTSの特徴は、
1)バキスゼブリア接種後4~28日に起る、
2)脳静脈や内臓静脈など、普通はあまり起らない場所の小血管に小さな血の塊(血栓)が生じ、組織に深刻な障害を起す、
3)血小板が著しく減少し、身体の出血凝固系に異常を生ずる、5)抗血小板第4因子抗体(ELISA法)が陽性となるという免疫異常が起る、が挙げられます。
TTSの頻度は、100万人に15人と極めてまれですが、これまでに報告されたTTSは、出血や著明な脳浮腫を伴う重症脳静脈の血栓症が多く、死亡率も高いです。
原因はよくわかっていませんが、ワクチン接種によって、何らかの血小板に対する異常な免疫反応が起るためと考えられています。
TTSの症状は、激しい頭痛が続く、目のかすむ、息切れ、胸痛、錯乱、けいれん、胸の痛み、足のやむくみや痛み、持続する腹痛、接種部位以外の内出血(あざ)などが挙げられています。これらの症状がみられれば、すぐ受診する必要があります。
2回目の接種後よりも1回目の接種後に起きることが多いとされています。
②毛細血管漏出症候群(capillary leak syndrome):からだの毛細血管から液体が漏み出し、手足のむくみ、低血圧などの症状が起こり、全身の浮腫や腎不全などを引き起こす、非常に珍しい病気です。
ワクチン接種とこの病気の関連ははっきりしませんが、この病気にかかったことのある人がバキスゼブリアを接種すると毛細血管漏出を起すリスクのあるため、接種は受けられません。
③ギランバレー症候群:手足の力が入りにくい、歩けなくなる、腱反射が出なくなるなどの症状がでる神経の病気です。バキスゼブリア接種でギランバレー症候群が稀に起ります。
6)ワクチンの対象
原則、40歳以上の成人が対象となりました。(一応、18歳以上は接種可能です。)
1.18歳以上の方で次のいずれかに該当する者
・ポリエチレングリコール(PEG)に対するアレルギー等で、mRNAワクチンを接種できない人
・海外ですでにバキスゼブリアを1回接種している日本在住の人
2.40歳以上で、バキスゼブリアの接種を希望する人
7)問題点
当初は、冷凍が必要ないこと(通常のワクチンの取り扱いで良いこと)、小分けが可能なこと、価格が比較的安価なことなどから広く使用されることが期待されました。
しかし、mRNAワクチンに比べて効果が劣ること、血栓症のような重い副反応の報告があること、オミクロン株に効果が低いことなどから、あくまでmRNAワクチンの補完の位置に甘んずることになりました。
参考文献・サイト
厚労省:アストラゼネカ社の新型コロナワクチンについて
MHRA:Vaxzebriaの製品特性の概要
④ヌバクソビッド(ノババックス社製の遺伝子組換え蛋白ワクチンワクチン)
1)開発元
アメリカノババックス社が開発したワクチンを、武田薬品が承認申請を行い、2022年4月19日に薬事承認されました。2022年5月下旬以降に、我が国でも使用できるようになりそうです。
(写真は、EPR:Novavax begins Phase III COVID-19 vaccine efficacy trial)
2)作用機序
ヌバクソビッドは、新型コロナウイルス=SARS-CoV-2のスパイク蛋白(いつもでてくる、コロナウイルスのトゲの部分の蛋白。スパイクはヒト細胞のリセプターにくっついて、ウイルスがヒト細胞内に侵入するために必要な働きをします。下図左)と、免疫を増強するためのMatrix-M1アジュバント(サポニンとコレステロール、ホスファチジルコリンで作られたケージ状粒子。下図右)を併せ持つ、遺伝子組換え蛋白ワクチンです。

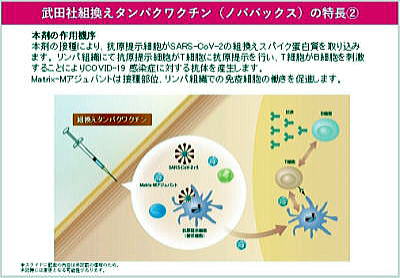
左はナノ粒子を囲んで集合したスパイク蛋白。右はサポニン、コレステロール、脂質のアジュバンド。(第31回 厚生科学審議会予防接種・ワクチン分科会資料より引用)
本剤の接種により組換えスパイクタンパク質がヒトの細胞内に取り込まれると、スパイクタンパク質に対する中和抗体産生及び細胞性免疫応答が誘導されることで、SARS-CoV-2による感染症の予防ができる。(引用は左と同じ)
mRNAワクチンがRNAをヒト細胞に接種するのに対し、組換え蛋白ワクチンは昆虫細胞に作らせた蛋白を接種します。
接種されたスパイク蛋白は免疫細胞(抗原提示細胞)に取り込まれ、異物(敵)として認識され、この情報は免疫司令官Tリンパ球に伝達されます。Tリンパ球はBリンパ球に指令を出し、Bリンパ球は中和抗体を産生し、スパイク蛋白を持つコロナウイルスを攻撃します。
同時に注入された、サポニンのMatrix-M1アジュバントは、免疫組織の働きを促進します。
この遺伝子組換え蛋白ワクチンは不活化ワクチンの一つで、B型肝炎ワクチンと同じグループに属します。(①ワクチンの種類、Ⅱ不活化ワクチン参照)
3)接種の方法
①ヌバクソビッド0.5mlを、3週間隔で2回、筋肉注射する方法(初回接種)
アメリカ、メキシコで行われた、18歳以上を対象とした臨床試験の結果では、ヌバクソビッド初回接種後約3か月における発症予防効果は、90.4%と報告されています。(2020年12月~2021年2月実施)
また、接種後7日目までの副反応は軽度~中等度で、追跡期間中に安全性の懸念は認められなかったと報告されました。
Dunkle LM,Kotloff KL, Gay CL, et al. Efficacy and Safety of NVX-CoV2373
in Adults in the United States and Mexico. N Engl J Med. 2022;386(6):531-543.
②ファイザー、アストラゼネカワクチンを2回接種した後に追加接種する方法
ヌバクソビッドを最初から接種するのではなく、コミナティ(ファイザー)やバキスゼブリア(アストラゼネカ)を接種した後、3回目として接種する効果をみた臨床研究が、2021年6月にイギリスで行われました。
30歳以上を対象としたこの試験の結果は、初回接種でファイザーワクチン又はアストラゼネカワクチンを接種した後にヌバクソビッドを追加接種した場合(交互接種)でも、中和抗体価は被接種対照群と比較して有意に上昇していました。
また、副反応についても安全性は許容される範囲であったと報告されました。
Alasdair P S Munro,et al:Safety and immunogenicity of seven COVID-19 vaccines
as a third dose (booster) following two doses of ChAdOx1 nCov-19 or BNT162b2
in the UK (COV-BOOST): a blinded, multicentre, randomised, controlled,
phase 2 trial ;Lancet.2021;398, I2258-2276
4)問題点
オミクロン株流行前の臨床検討では、コミナティやスパイクバックスなどのmRNAワクチンよりは効果が劣るものの、ウイルスベクターワクチンであるバキスゼブリアよりは有効だったようです。
また、副反応については現在の検討結果では、重い症状は報告されていません。ただし、まだ接種数全体が少ないので、今後未知の副反応が報告される可能性はあります。しかし、同じグループであるB型肝炎ワクチンが、ほとんど重篤な副反応がみられないことから、重い副反応が今後報告される可能性は少ないものと思われます。
また、mRNAワクチンの3回目の代わりに、選択肢としてヌバクソビッドを追加接種することも可能であることが示されました。
5)日本での接種計画
5月下旬から接種可能になると思われるので、今後mRNAワクチンで副反応が強かった人、mRNAワクチンを打ちたくない人用のワクチンとして、使われていくと思われます。
また、武田薬品工業が国内で製造しているため、安定供給が可能なこともメリットとして挙げる人もいます。(といいつつ、国内で流通している国産ワクチンが製造上の問題で欠品続きになっている現状では、この意見には同意しかねます。)
参考文献・サイト:
第31回 厚生科学審議会予防接種・ワクチン分科会資料
厚労省:武田薬品工業株式会社の新型コロナワクチンについて
大岩ゆり:ノババックス製ワクチンの特徴は? ファイザー、モデルナとどう違う ?;Reライフ・ネット ![]()